- 임상시험 기관마다 관리감독기관 상이, 확인 필요 -
말레이시아 임상시험 시장 현황 및 전망
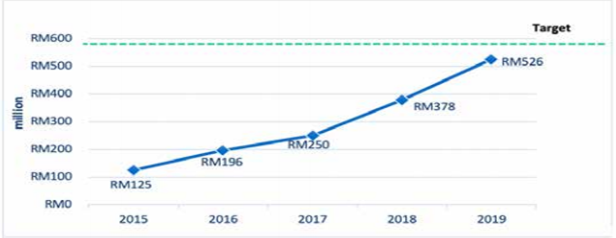
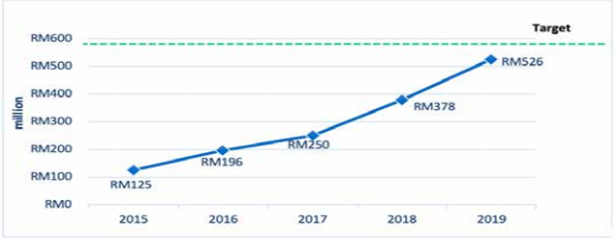
말레이시아 임상시험 관리 기관인 Clinical Research Malaysia(CRM)는 말레이시아 정부에서 임상시험산업을 경제 견인 사업으로 지정함에 따라 2012년 Centers of Disease Control and Prevention(CDC)에서 분리돼 독립적으로 설립된 임상시험 관리 기관이다. 말레이시아는 다인종으로 구성돼 있으며, 아시아를 대상으로 하는 임상시험의 테스트베드로 적합하다는 평가를 받고 있다. CRM에 등록된 신규 또는 진행 중인 임상시험은 2018년 1238개에 이어 2019년에 162개가 추가 등록돼 1400개를 기록했다. 2019년 1400개로 진행된 임상시험이 말레이시아 국민총소득(GNI)에 기여한 금액은 약 416억 원으로, 2018년에 비해 40%가량 증가했다. CRM의 예측으로는 2020년에 다시 10%가량 CNI 기여도가 증가할 것으로 예상된다.
2015년 이후 임상시험 시장 성장 추이
자료: Clinical Research Malaysia(CRM)
임상시험 비교 (2018년, 2019년)
(단위: 건, %)
| 유형 | 2018 | 2019 | ||
| 건수 | 비중 | 건수 | 비중 | |
| 기관 개입 임상시험 | ||||
| Phase 1 | 6 | 2.86 | 1 | 0.62 |
| Phase 2 | 13 | 6.2 | 17 | 10.5 |
| Phase 3 | 70 | 33.33 | 44 | 27.16 |
| Phase 4 | 41 | 19.52 | 3 | 1.85 |
| BA/BE | 37 | 17.62 | 26 | 16.05 |
| 기타 | 1 | 0.5 | 9 | 5.55 |
| 계 | 168 | 66.4 | 100 | 62 |
| 기관 비 개입 임상시험 | ||||
| 비개입 | 42 | 33.6 | 62 | 38 |
| 총 계 | 210 | 100 | 162 | 100 |
부위별 임상시험 종류 현황
말레이시아에서 진행된 임상시험 중 가장 많은 시험이 진행되는 분야는 암과 심혈관 관련 질환이다. 말레이시아에서는 위의 질환으로 사망 사례가 가장 많은데 관련 임상시험을 진행하는 기관으로는 말라야 대학(University of Malaya)이 54건으로 가장 많으며, 그 뒤로 페낭 병원 (Hospital Pulau Pinang), 암팡 병원 (Hospital Ampang)이 각 28개와 23개로 많다.
치료 부위별 임상시험 진행 건수 비교(2018년, 2019년)
(단위: 건)
| 유형 | 건수 | |
| 2018 | 2019 | |
| 종양 | 18 | 25 |
| 혈액 | 15 | 15 |
| 심장 | 20 | 14 |
| 소아 | 8 | 13 |
| 전염병 | 15 | 11 |
| 폐 | 5 | 8 |
| 신장 | 5 | 7 |
| 간장 | 3 | 6 |
| 피부 | 3 | 6 |
| 신경 | 3 | 4 |
| 위장/소화기 | 12 | 4 |
| 산과 | 0 | 4 |
| 류머티스 | 1 | 3 |
| 정신의학 | 2 | 3 |
| 안과 | 1 | 3 |
| 영양학 | 2 | 3 |
| 내분비학 | 5 | 3 |
| 비뇨기과 | 0 | 2 |
| 정형외과 | 2 | 1 |
| 트라우마 | 1 | 0 |
| 기타 외과 | 2 | 0 |
| 기타 | 9 | 1 |
| 총계 | 132 | 136 |
말레이시아 임상시험 규제기관
말레이시아 임상시험은 국가 의약품 관리청(National Pharmaceutical Control Bureau, NPCB)과 의료기기 관리청 (Medical Device Authority, MDC)에서 관리되며, 생명윤리위원회(Independent Ethics Committee, IEC와 Institutional Review Board, IRBs)와 의학연구윤리위원회(Medical Research & Ethics Committee, MREC)의 감독을 받게 된다.
임상시험에서 국가 의약품 관리청 (NPCB)의 주요 역할은 다음과 같다.
- ① 약품의 품질, 효과, 안전 점검
② 의약 관리 기관(Drug Control Authority. DCA)의 권한 대행
임상시험용 의약품 수입 및 임상시험 면제 신청 절차
말레이시아에서 임상시험을 진행하고자 할 때는 임상시험용 의약품 수입허가 및 임상시험 면제 허가를 받아야 관련 의약품의 수입 및 생산이 가능한데, 의약품 관리청을 통해 신청하고 의약 관리기관에서 허가를 받아야 한다. 신청 시 신청서*와 함께 증빙서류를 제출해야 하는데, 서류의 구성은 다음과 같다.
- ① 목차 및 소개서(기관 소개 및 임상시험에 대한 소개)
② 임상시험용 의약품 수입 및 임상시험 면제 신청서, 관련 비용 및 회사 등록서류
③ Type A 독극물 면허증(민간 의약 기관) 또는 ARC(Annual Retention Certificate) (공공 의약 기관)
④ 임상시험 허가증과 약물 의약 관리 기관의 견해서
⑤ 임상시험 프로토콜과 관리 및 감독기관 지정, GCP** 증명서와 이력서(관리 감독 인의 이력은 NCCR, MOH에서 인정을 받아야 함)
⑥ 협조 요청서 및 의약품에 대한 데이터 정보와 수반되는 라벨(표) 부착
⑦ 생산과 포장을 담당한 기관의 GMP 증명서
⑧ 위험 및 혜택에 대한 평가, 기타 서류
주**: 임상시험관리기준(Good Clinical Practice)
윤리위원회
임상시험 윤리위원회는 임상시험을 진행하는 기관에 따라 나뉘게 되는데 병원에서 진행하는 시험들은 자체 윤리위원회에서 관리가 되는 반면, 보건복지부 소속 병원에서 진행하는 시험들은 모두 보건복지부 의학 연구윤리위원회(MOG MREC)에서 관련 시험에 대한 관리 감독을 받게 된다. 임상시험의 신청은 NPCB에서 진행이 되지만 관련 시험은 윤리위원회에서 임상시험 가능 여부를 승인해줘야 진행할 수 있다. 윤리위원회 임상시험 승인 시일은 약 근무일 기준 30일에서 50일 가량 소요된다.
윤리 위원회 구분
| 명칭 | 기관의 책임 |
| 독립 윤리 위원회 (Independent Ethics Committee, IEC) | 의약/과학 전문가 및 비의학/비과학적 회원으로 구성된 독립기관(심사위원회 또는 위원회, 기관, 지역, 국가 또는 초국가적). 시험에 관련된 인간 피시험자의 권리, 안전 및 복지의 보호를 보장하고 임상시험 계획서, 임상 시험자의 적합성, 시설, 시험대상자의 사전 동의를 얻고 문서화 등 그 보호에 대한 공적 보증을 제공하는 것 |
| 기관심사위원회 (Institutional Review Board, IRB) | 의약, 과학 및 비과학적 회원으로 구성된 독립 기관으로 임상시험에 참여하는 피시험자의 권리, 안전 및 복지의 보호를 보장하는 책임을 짐. |
임상시험 승인 소요 시일 국가별 비교
| 국가명 | 시일 | 제출 | |
| 규제 승인 | 윤리 승인 | ||
| 싱가포르 | 약 30일 | 약 30일 | 동시 제출 |
| 말레이시아 | 근무일 기준 약 30일 | 근무일 기준 약 50일 | 동시 제출 |
| 대한민국 | 약 30일 | 약 50일 | 동시 제출 |
| 홍콩 | 근무일 기준 30-60일 | 30-60일 | 동시 제출 |
| 일본 | 불가 통보 없을 시 자동 승인 | 4-8주 | 순차 제출 |
| 대만 | 근무일 기준 약 30일 | 근무일 기준 약 30-60일 | 동시 제출 |
임상시험 시 약물 이상반응
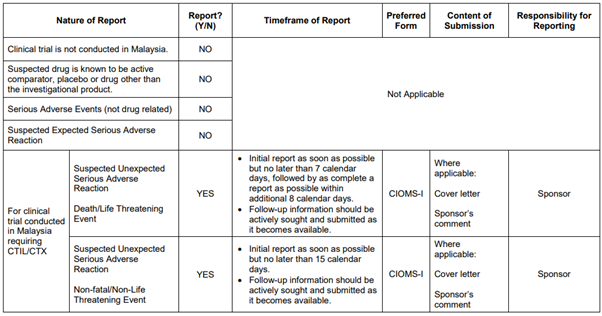
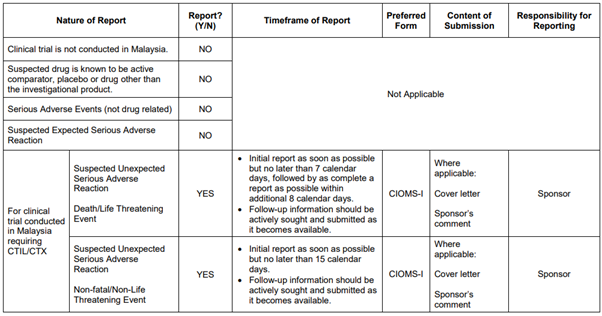
임상시험을 진행하던 중 예상치 못한 약물 반응이 일어날 수 있다. 약물 이상 반응(Adverse Drug Reaction, ADR)이 일어날 경우 이에 대한 보고는 말레이시아에서 임상시험에 사용된 제품에 대한 허가 및 승인된 날짜로부터 시작되며, 시험이 폐쇄될 때까지 계속돼야 한다. 약물 이상 반응에 대한 보고 시 사안의 경중에 따라 보고하는 방법이 달라지는데 생명을 위협하는 사례일 경우 관련 사례를 인지한 후 근무일 기준 7일 이내로 NPCB에 통지 및 보고를 해야 하며, 이후 추가 8일 이내 완성된 형태의 보고서를 제출해야만 한다. 그 외 기타 중대한 사항이라고 판단이 될 경우 사례 인지 후 15일 이내에 NPCB에 통지를 해야 한다.
NPCB에 통지를 할 때, CIOMS-I 서식을 작성해 함께 보고해야 한다. 여기서 사용되는 CIOMS 서식은 국제의학기구협회에서 사용되는 이상 반응 보고서와 동일하다.
· 제출 이메일 주소: mysusar@bpfk.gov.my
CIOMS-I 서식
자료: 국가 의약품 관리청(National Pharmaceutical Control Bureau. NPCB) 안전성 보고 지침서
임상시험용 신약 센터 보고 요구사항 및 일정
자료: 국가 의약품 관리청(National Pharmaceutical Control Bureau. NPCB) 안전성 보고 지침서
요약 및 시사점
말레이시아 임상시험은 주로 대학병원과 보건복지부 지정병원에서 진행되고 있으며, 최근에는 사립 의료센터(Clinical Research Organization, CRO)에서의 임상시험도 늘어나고 있는 추세다. 말레이시아는 말레이계, 중국계, 인도계 등 다양한 인종으로 사회가 구성돼 있어 아시아를 겨냥한 임상시험의 테스트베드로 활용되고 있다.
말레이시아 Clinical Research Malaysia(CRM)에 등록된 임상시험 기관은 보건복지부 병원 4개, 사립 병원 25개, 공공 병원 84개 등이 많은 임상시험 설비를 갖추고 있으며 162개의 임상시험이 진행되고 있다. 또한 2019년 기준 말레이시아에 진출한 65개의 사립 의료센터(CRO)에서도 임상시험을 후원하거나 별도 기관들과 합동 연구를 진행하고 있다.
말레이시아는 의약품 관리청과 생명윤리위원회에서 대부분의 규제와 관리를 담당하고 있다. 가장 중요한 것은, 실제 임상시험을 진행하기 전 NPCB와 윤리위원회 양측에서 모두 승인이 돼야 진행할 수 있다는 점이다. 또한, 생명과 직접적인 연관이 되는 만큼 약물 이상반응이 확인됐을 때의 대처 방안을 확실히 숙지하고 있어야 큰 사고를 방지할 수가 있으며, 모든 교신에는 의료 등록기관에서 발급한 임상시험승인 번호가 필수적으로 기재되어야 한다는 부분이다.
정부에서도 11차 경제계획의 견인 사업 중 하나로 임상시험 시장을 지목해 육성하는 만큼 산업에 연관 있는 우리 기업들에도 많은 기회가 열릴 것으로 보인다. 말레이시아 임상시험 시장에 진출하려는 우리 기업들은 관련 규정과 담당 기관에 대한 이해가 선행돼야 하며, 진출 시 규정을 준수하고 요구되는 서류들을 면밀하게 사전에 준비를 해야 시장진출에 어려움이 없을 것이다.
자료: 말레이시아 정부 포탈 및 KOTRA 쿠알라룸푸르 무역관 자료 종합






























![[초점] 트럼프와 갈등 머스크, ‘신당 창당’ 공언…美 정치지형...](https://nimage.g-enews.com/phpwas/restmb_setimgmake.php?w=80&h=60&m=1&simg=20250703101302001499a1f3094311109215171.jpg)












