임준환 PT. Green Nature Farm 대표(jhlim9971@hanmail.net)
지난 기고에 인도네시아 건강기능 식품과 화장품 시장 진출에 대한 사전 허가와 수입 신고 준비 사항에 대한 업무 소개를 했다. 이번 시간에는 인도네시아 시장 신규 진출을 위한 사전 준비로 BPOM 인증 현황과 추가 개정 사항을 살펴보았다.
인도네시아 영토 내에 건강기능식품, 일반가공식품 등과 또 화장품의 자국내 수입 유통을 위하여는 사전 인도네시아 식약청인 BPOM에 관련 제품의 사전 등록 허가를 받아야 한다. 또한 실 수입 시에는 통관 준비 서류 중에 선적 관련 서류 이외 필수적으로 식약청으로 부터 기 등록 허가 받은 제품의 수입 유통 신고 SKI(Surat ketrangan Impor) 확인서를 발급 받아 세관에 제출해야 한다.
1. 인도네시아 식약청의 업무 소개 – 제품별 등록 유형
식약청(BPOM)은 의약품/의약외품/전통의약품/건강기능식품/일반가공식품/전문식품/화장품에 대한 제품 심사 평가와 허가 업무를 담당하고 있다. 이번 시간에는 일반 기업들이 취급 가능한 제품 유형에 대해 소개 하고자 한다.
1) 전통의약품 (TI): 건강기능식품은 두 개 유형으로 구분된다. 한국에서 흔히 한약재(허브재료)가 들어간 제품은 전통의약품으로 구분 된다. 의약품 보다는 한 단계 아래이나 재료의 기능성과 효능을 입증할 근거를 마련해야 하는 등 준의약품 수준으로 인허가 준비가 필요하다.
2) 건강기능식품(SL) : 위의 제품 중 허브 재료가 포함 되지 않거나 주 재료의 목적이 아니며, 비타민류, 미네랄류, 아민류가 포함 된 식품은 건강 기능 식품으로 분류된다. 특이 사항으로는 한국의 경우는 '건강기능식품은 어떤 기능에 도움을 줄 수 있다'라는 의미의 허가지만 인니에서는 '기능과 용도가 명확해야 하고 또 그 근거를 갖춘 경우에만 어떤 해당 기능 및 용도에 대하여 도움을 준다' 라고 명시 할 수 있어 한국의 건강기능식품과는 그 평가와 심사가 매우 까다롭다. 마찬가지로 준의약품 수준의 평가 심사가 따른다.
3) 일반가공식품(ML) : 일반 식품 및 기타 가공 식품 및 음료 제품이 해당 된다. 제품 자체 기능에 대해 포장 라벨에 광고성 표기를 할 수 없다. 제품명 자체에 홍보성 특정 단어의 사용도 금하고 있다. 허가 조건부로 필요 시 특정 기능을 명시한 부분은 스티커로 가리거나 삭제가 필요하다.
4) 전문식품 (ML) : 일반가공식품 중에서도 전문 다이어트 식품, 스포츠 식품 등이 전문 식품으로 구분되며 이 경우는 허가 대상 분야 표기와 홍보성 문구, 특정한 의미를 가지고 있는 전달성 제품명까지 사용할 수 있으나 전문식품 자체 대상이 적고 사전에 안전평가관리국의 심의를 받아 해당 분야를 인정 받은 후에야 접수가 가능하다.
5) 화장품 (NA) : 일반적인 모든 화장품과 미용 물티슈, 헤어 관련 겔 , 삼퓨 그리고 손세정제, 여성청결제, 미용 비누, 바디용 세제 등다양한 제품이 해당된다. 특이한 부분은 한국의 의약외품인 치약은 인니에서는 화장품류에 포함 되어 해당 심사를 받아 등록 관리 되고 있다.
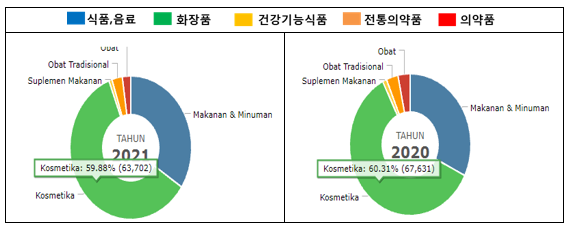
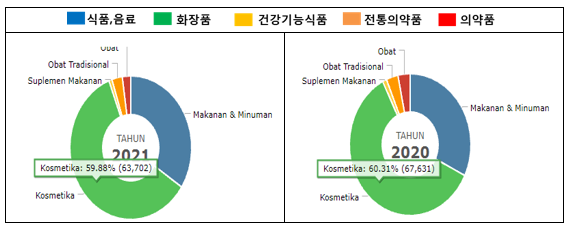
인도네시아 식약청에 따르면 BPOM 등록은 아래와 같이 화장품이 앞도적으로 많으며, 이는 인도네시아 시장 중 화장품 시장이 가장 빠르게 성장하고 있고 경쟁도 치열함을 볼 수 있다. 화장품은 2018년도부터 등록 허가 시스템의 절차와 심사 기준의 개편으로 허가가 비교적 용이해짐(2017년도 까지는 전체 허가 비율에 10%미만)에 따라 그 등록건수가 증가했다. 이에 따라 신제품의 출시가 시장에 적용에 빠르게 반영되고 있는 점도 참고 할 수 있다. 2021년 10월 기준으로 화장품은 63,702건이 등록되었다.
인도네시아 식약청 등록 현황
자료: 인도네시아 식약청
인니 식약청인 BPOM 등록 시 제조사의 국가에서 평가 받은 식품 또는 건강보조식품 등의 등급은 상관이 없다. 인도네시아에서는 위 제품 유형 구분과 같이 제품의 제조에 사용된 전성분의 구성 사항에 따라 일반 식품-가공식품과 건강보조식품-전통의약품 등급을 나누어 접수와 심사 평가를 하고 있다. 이에 한국에서 기타 혼합 음료로 한국 식약처에 신고가 된 제품이라도 인도네시아 기준에 따라 건강보조식품으로 등록을 진행해야 하는 어려움이 있다. 또는 그 반대로 건강기능식품으로 한국에 신고 등록 되었으나 인니에서 일반식품유형으로 등록하는 경우도 조건이 맞는다면 가능하다.
2. 인도네시아 식약청(BPOM) 주요 등록 업무 및 개정 업무 주의 사항
1) 전통의약품 및 건강기능식품
GMP 허가 공장에서 생산 제품일 경우라도 health functional food GMP, 즉 건강기능식품 GMP 허가 공장의 경우 SMF(site master file) 서류를 구성하여 인니 식약청에서 제출 및 추가 평가를 통해 승인을 받아야 하는 문제가 있다. 이 SMF 구성은 WHO 규정에 근거하여 구성되어야 하나 그 구성의 세부 내용이 평가되고 있으며 이는 실제 BPOM 등록 지연 사유 중 가장 많이 발생하는 건이다. 제약 GMP 보유 공장의 경우는 바로 제조사의 등록이 가능 하다.
한국 제조 환경의 현실을 볼 때 인니 요구 조건인 기술 서류 중 안정 보고서(Stability Report) 준비가 사전에 되어 있는 제조업체는 많이 없을 것으로 보인다. 이 Stability Report 내용에서 전성분의 활성(active) 재료에 대한 순도 범위(Assay range) 평가에 최소 6개월에서 3년의 시험 검사 데이터가 포함 되어야 하기 때문이다. 이에 인니 조건을 맞추기 위하여 가속성 조건(Acceleration test : 40℃± 2 ℃ / 75 ± 5 % RH) 에서 최소 6개월간 축적된 평가 자료가 보고서로 작성 제출 되어야 한다. (참고 Long-term Test : 30± 2 ℃ / 75 ± 5 % RH)
건강기능식품 및 전통의약품의 수입사는 해당 분야의 PSB(Pemeriksaan sarana Bangunan)를 중앙 BPOM에 접수 하여 심사 및 현장 감사를 받아 허가를 취득 하여야 개별 제품의 등록 신청을 개시 할 수 있다. 현재 신규 개정으로는 책임관리인의 전공분야 약사로 지정하고 채용 의무화 하여 정규 직원으로 두어야 한다는 규정으로 신규 허가 및 갱신 업체들의 어려움이 있다.(근거: 인도네시아 식약청장령 2020년 7월- No.11호)
2) 일반 가공 식품
제품의 등록을 위하여는 수입사는 수입 유통 및 창고 허가를 취득 한 후 제품의 등록 접수 신청을 할 수 있다. 이때 기존의 PSB(Pemeriksaan sarana Bangunan))의 관할 주소지 지방청의 접수와 심사 평가가 현재 전산 통합 신규 개정 적용되어 SMKPO(SISTEM MANAJEMEN KEAMANAN PANGAN OLAHAN)로 온라인으로 일괄 접수 하여 서류 심사 평가 후 Cetificate를 발급 받고 관할 지방청은 업체의 현장 감사와 감독을 후 관리 하는 방식으로 변경 되었다. (근거: 2021년 8월 식약청 신규 개정안)
일반 가공식품 등록 유지 관리 사항 주요 개정 내용은 아래와 같다.
- 포장디자인의 변경, 수정에 의한 변경 신고 후 이전 구 포장 디자인 제품의 수입 유통 판매에 6개월간의 유예를 허용에서 기간을 추가 하여 12개월까지 수입 유통 판매가 가능토록 허용.
- 허가 등록의 유효 기간 종료 후 기 유통 제품에 대하여 6개월간 유통 판매가 허용 되었으나 이를 완화 하여 12개월간 유통 판매가 허용하도록 개정(근거: Perka BPOM No. 7 tahun 2021 tentang Perubahan Perka BPOM No. 27 tahun 2017 tentang Pendaftaran Pangan Olahan)
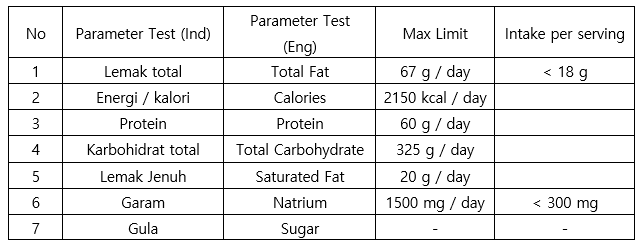
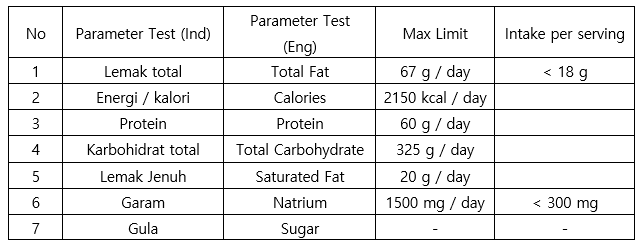
- 영양성분 표기 의무 사항으로 인도네시아 시험 검사 기관의 결과서를 기준으로 기재 필수
영양성분 표기 의무 사항 및 기준
자료: 영양성분 검사 항목 규정 식품의약청(BPOM) 규정 2019년 22호(의무 2020.2.10.)
그 다음은 제품 라벨 표기의 할랄성 여부에 따른 경고 문구 라벨링 유의 사항이 있다. 돼지 파생 재료가 들어간 식품은 아래와 같이 제품에 별도 표기가 필요하다.
돼지 파생 재료가 들어간 제품에 필수적으로 부착해야하는 문구
자료: 인도네시아 식약청, PT. Green Nature Farm
그림의 표기 사항은 ‘ 본 제품은 돼지 파생 재료가 공장 시설내 공유 접촉이 될 수도 있던 제품’이란 의미로써 이는 하람 재료가 포함된 제품이 아니나 한국 식품의약품안전처 「식품등의 표시기준(식약처 고시 제2016-149호)」에 의거 한국 알레르기 유발 재료 표기 의무에 따라 ‘돼지고기, 돼지’의 문구가 포장지에 포함된 제품에 대하여 식약청(BPOM)에서는 돼지고기를 원재료로 사용하지 않은 제품이라 하더라도 돼지고기를 사용한 제품과 같은 제조시설에서 생산된 경우 한국은 알레르기 유발 문제로 인해 경고 문구를 삽입하도록 하고 있어 현지 시장 유통 및 판매대의 구분에 따른 소비자 접근에 있어 불리하게 작용하고 있는 점 인지가 필요하다.
3) 화장품
화장품 등록 인허가는 다른 유형의 제품보다 용이해 서류적 요건을 갖추면 사전 허가를 받을 수 있다. 다만 후속 관리적 개념에 따른 현지 수입 및 유통업자의 그 책임과 관리 감독 규정은 강화되고 있는 추세다.(근거: Peraturan BPOM No. 2 Tahun 2020 Tentang Tata Cara Pengajuan Notifikasi Kosmetika)
2020년 식약청 제 2호 17조항 규정(Peraturan BPOM No. 2 Tahun 2020 Tentang Tata Cara Pengajuan Notifikasi Kosmetika)에 의하면 화장품의 수입 유통 회사는 각 제품별 포장 단위의 제품으로 LOT(또는 Batch)별 샘플을 최소 1여년간 보관 비취 관리 되어야 한다.(유효기간 경과 후 기준) . 본 제도는 1년간 시행을 유예하여 2021년부터 적용되었다.
동 규정의 5조 7조 13항에 의거 화장품의 창고 유통 허가를 지방 식약청으로부터 허가를 받아야 한다. 이는 식품 및 건강기능식품의 창고 및 유통 허가인 PSB(Pemeriksaan sarana Bangunan) 의 같은 허가를 받아야만 신규 수입사 등록 및 제품 등록을 할 수 있게 된다.
책임관리인의 지정 의무, 책임관리인은 약학전공자, 의학전공자, 생물학, 화학 전공자 중 1명을 책임 관리인으로 지정하고 정규 직원으로 두어야 한다.(동 규정 11조)
제 16조 규정에 의거 수입 및 유통 판매사는 매 최소 6개월 마다 화장품 안전 관리국에 제품의 수입 및 판매 현황, 재고 현황을 서면으로 보고 하여야 한다.
해당 규정은 규정은 2020년 2월 5일 발효 되었으며, 유예 기간은 1년을 둔다(근거: Peraturan BPOM No. 12 Tahun 2020 Tentang Tata Cara Pengajuan Notifikasi Kosmetika)
화장품의 해외 제조사는 GMP 인증을 필수 사항이며, ISO 22716의 경우는 화장품 제조 확인서 또는 화장품 제품 생산 확인서를 추가 발급 받아 제출 되어야 하며 화장품의 갱신은 최소 유효기관 완료 1개월전에 갱신 절차가 개시 되어야 한다. 유효기간의 도래되고 연장을 하지 않은 제품의 국내 잔여 재고의 유통 허용은 6개월간 유예가 가능하다.
화장품 분류 유형 카테고리는 과거 20개 Type과 34개 Category, 115개의 Sub category에서 20개 Type과 122개의 Category개정 되었다.
4) 수입신고제도(surat ketrangan impor : SKI)
수입신고제도는 BPOM 으로 부터 허가 받은 모든 등록 제품의 매 수입 시 마다 신고 확인서를 신청하고 발급받는 및 발급하는 절차를 뜻한다. 신청서류로는 Surat Prtmohonan(신청서), Surat Kuasa(신청인의 위임장) , Surat Peryataan(수입 제품의 세부 현황), 의 준비와 NIE(등록 허가증) 사본이며, 선적 서류로는 Iovoice, Packing list, BL(awaybill) 의 준비가 필요하다. 그리고 제일 중요한 선적 제품의 시험성적서(제조사 발급)를 제출 해야 한다. 접수처는 https://e-bpom.pom.go.id/ 다. 더해서 필요 문서 양식과 절차 등의 정보는 BPOM 규정 2017년 30호를 참조 할 수 있다(e-bpom.go.id)
결론 및 제언
인도네시아의 온라인 거래량과 입점수는 팬데믹 이전 수준의 회복을 보이고 있으며 이는 전 상품 산업 분야에 고르게 확장 증가를 보이고 있다. 소비 경향과 소비자 활동 환경에 따른 고객별 기대 요구에 맞추어 전개 전략이 필요 할 것으로 사료한다. 또한 시장 특성과 변화의 움직임에 빠른 진입을 위한 인도네시아 등록 인허가청의 업무와 사전 준비에 대한 학습과 정보 수집이 매우 중요하다.
인도네시아의 건강기능식품, 일반 가공식품, 전문식품, 화장품 시장 개척과 원활한 진입 그리고 유통을 위해서는 수입자만의 노력으로는 부족함과 어려움 있다. 한국의 제조 수출 기업 또한 인니 규정과 유지 관리에 필요한 서류적 준비에 많은 협조와 지원이 필수적임을 재차 강조하고 싶다.
필자는 다음 기회에는 보건산업 관련 제품과 할랄 인증 개정 및 신규 동향에 사항 또한 현장의 적용 상황을 소개토록 준비 하여 우리 기업의 우수품질의 경쟁 제품의 수입과 수출 업무 준비에 참고가 되어 성공적인 비즈니스로 계속 발전 되기를 기원 한다.
※ 이 원고는 외부 전문가가 작성한 정보로 KOTRA의 공식 의견이 아님을 알려드립니다.